23 / 08 / 27
医药观察 #18:重塑阿尔茨海默病
一个月前,阿尔茨海默病(Alzheimer’s disease)药物 donanemab 在国际阿尔茨海默病联盟大会(AAIC)公布了 3 期临床试验 TRAILBLAZER-ALZ 2 的具体数据 (Sims, Zimmer, and Evans 2023)。当介绍疗效数据的讲者上台,观众报以热烈掌声,足见这项试验的重要性。据 Alzforum 报道 ,今年的 AAIC 会场洋溢着久违的乐观气氛:一款阿尔茨海默病新药加速获批上市,一款新药时隔 20 年正式获批上市,现在又有一款新药成功证实疗效——一连串好消息成了与会者的强心剂。
试验数据我不再赘述,仅强调三点。这些发现来自 TRAILBLAZER-ALZ 2 试验,但 donanemab 与另两款新药 aducanumab、lecanemab 同为抗 β 淀粉样蛋白(amyloid beta)单抗,难免对整类药物的临床应用产生深远影响。
-
TRAILBLAZER-ALZ 2 试验筛选受试者时,测定了患者大脑中的 tau 蛋白水平。tau 蛋白是阿尔茨海默病患者大脑特殊病变现象“神经纤维缠结”(neurofibrillary tangle)的主要成分,其水平高低或可提示患者病情严重程度。这项试验排除了 tau 蛋白水平过低的患者,参与临床试验的患者又按 tau 蛋白水平分成两组:低至中等水平、高水平,后者理论上比前者患病时间更久、病情更重。结果表明,donanemab 对 tau 蛋白高水平患者的疗效不及 tau 蛋白低至中等水平患者,符合大家对这类药物的预期。尽管 制药厂商坚称没有必要 ,临床医生在权衡用药获益、风险,寻找合适患者时,可能将大脑 tau 蛋白水平纳入考虑范围。
-
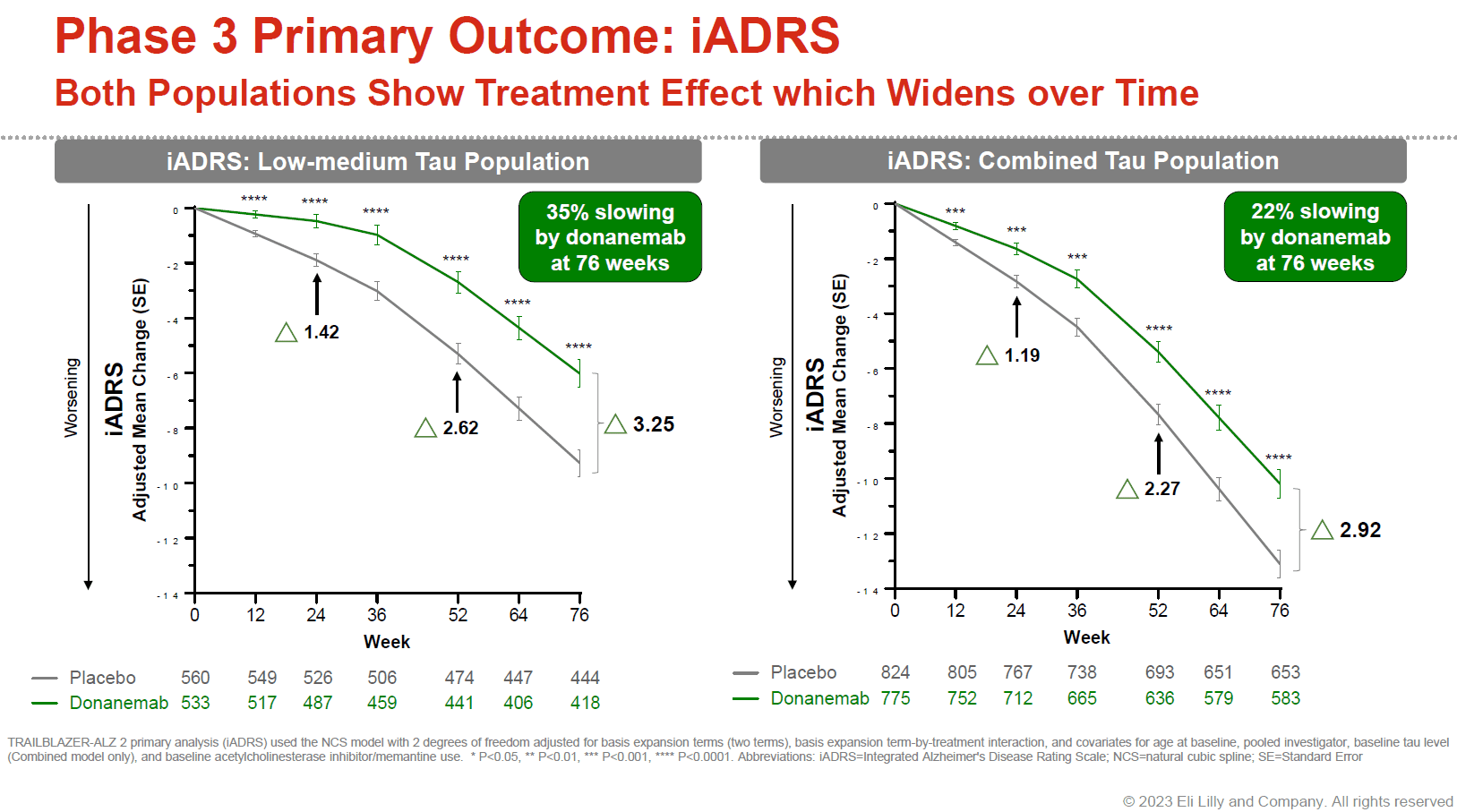
TRAILBLAZER-ALZ 2 试验治疗期间定期测定患者大脑中的淀粉样蛋白斑块(amyloid plaque)水平,这是阿尔茨海默病患者大脑的另一种特殊病变现象,是 β 淀粉样蛋白聚集的产物。如果水平过低,正在使用 donanemab 的患者会转为无效安慰剂治疗。毕竟 donanemab 通过清除淀粉样蛋白斑块发挥效果,既然脑内斑块水平过低,重新积累又需要数年时间,暂停用药也合情合理。由于 donanemab 清除斑块效果显著,全试验接近 80% 的受试者治疗一年后换成了安慰剂。但药物治疗组和一开始就使用安慰剂的患者,各疗效指标的差异不仅没有缩小,甚至继续扩大(见下图,来源:礼来官网 )。即使 aducanumab、lecanemab 都没有选择淀粉样蛋白斑块过低即停药的给药方案,临床医生用药时仍可能因为经济问题考虑这一方案。
-
药物安全性方面,淀粉样蛋白相关影像学异常 (ARIA)如达摩克里斯之剑,悬在所有抗 β 淀粉样蛋白单抗之上。先前 lecanemab 的死亡病例颇受争议,FDA 批准其上市时已经 充分考虑到已知危险因素 ,希望尽可能降低 ARIA,尤其致命性脑出血的风险。TRAILBLAZER-ALZ 2 同样报告了 3 例严重 ARIA 事件后死亡的病例,未必与 donanemab 或 ARIA 有关,但这些患者都未合并使用抗凝或抗血小板药物,表明我们对严重 ARIA 事件的认识远远不够。
今年 AAIC 上的另一条重磅新闻,是美国国家衰老研究所与阿尔茨海默病协会(NIA-AA)宣布 将修订其阿尔茨海默病临床指南 ,其中阿尔茨海默病定义——或诊断标准——的变化揭开了“重塑”的序幕。这两个组织的上一版临床指南发布于 2011 年,当时的阿尔茨海默病主要诊断依据是患者临床表现 (McKhann et al. 2011);他们在 2018 年又提出 阿尔茨海默病的生物标志物研究框架 ,但声明只用于科研,不建议用于临床实践。
然而,随着阿尔茨海默病患者的生物标志物数据逐渐积累,针对特定生物标志物的新药相继问世,NIA-AA 认为是时候改变了:阿尔茨海默病不是临床综合征,是可以通过生物学方法定义的疾病。这意味着诊断阿尔茨海默病不再仅仅依赖临床医生的主观判断,将像糖化血红蛋白(HbA1c)、血糖之于糖尿病,更依赖反映疾病生物学特征、过程的可量化指标(即“生物标志物”)。
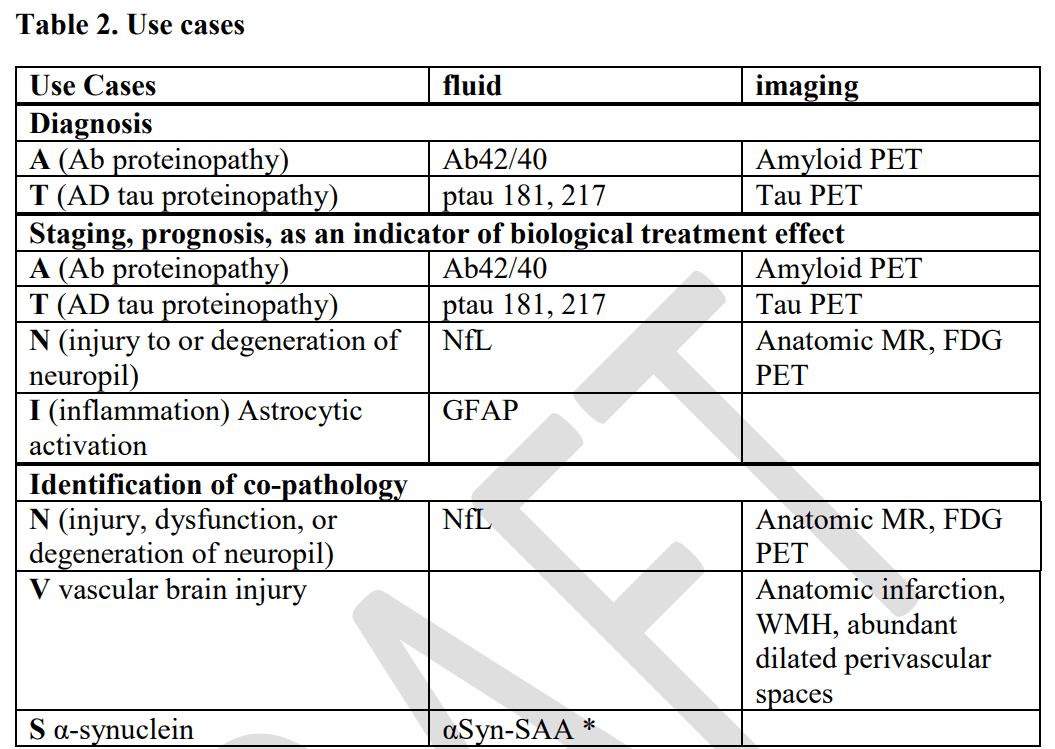
不同生物标志物在疾病发展过程中有不同作用和位置,NIA-AA 将它们分门别类(见下图,来源:NIA-AA 阿尔茨海默病临床指南 2023 版意见征求稿),或用作诊断标准,或用作疾病分期、预后判断……根据生物标志物的变化情况,NIA-AA 一并制定了疾病的生物学分期标准。对于极早期阿尔茨海默病患者,生物标志物已经异常,但尚未出现外人可觉察的症状。这些患者也被纳入疾病分期系统,新系统兼顾生物学、临床两方面,更加全面、完整。
阿尔茨海默病重塑影响的绝不止患者,整个相关医疗系统也将发生翻天覆地的变化 (Widera, Brangman, and Chin 2023)。临床医生需要尽快熟悉新的诊断标准,引入新的检测项目。诊断之后是治疗,临床医生需要了解新的药物信息,知道什么患者可以用、怎么用,掌握监测、规避、管理不良反应的方法。目前抗 β 淀粉样蛋白单抗都通过静脉定期给药,医疗机构需要完善硬件条件、人员资质,应对这一新患者群体。新药的高昂价格,新诊断方法的检测成本,以及严重不良反应发生时的额外支出,也必然因为阿尔茨海默病的高发病率,对现有医疗支付体系造成不可忽视的冲击。
两年前 aducanumab 通过替代终点加速获批 ,却一路坎坷。谁曾料今天已经有两款同类药物在 3 期临床试验中证实疗效。在新药和生物标志物研究的共同推动下,阿尔茨海默病也迎来重塑。我参与阿尔茨海默病新药临床开发时,最大困难是中国竟没有一款商业化 β 淀粉样蛋白 PET 示踪剂(tracer),难以根据临床试验方案要求的生物标志物诊断阿尔茨海默病。当时国内临床医生缺乏这样的需求,PET 检查本身昂贵,与其他痴呆病因区分对临床干预没有实质影响,又何必多此一举呢?偏偏是许多单独看来无用、花销巨大的尝试,最后串联起来推动现代医学不断向前。
参考文献
-
McKhann, Guy M., David S. Knopman, Howard Chertkow, Bradley T. Hyman, Clifford R. Jack, Claudia H. Kawas, William E. Klunk, et al. 2011. “The Diagnosis of Dementia Due to Alzheimer’s Disease: Recommendations from the National Institute on Aging‐Alzheimer’s Association Workgroups on Diagnostic Guidelines for Alzheimer’s Disease.” Alzheimer’s & Dementia 7 (3): 263–69.
-
Sims, John R., Jennifer A. Zimmer, and Cynthia D. Evans. 2023. “Donanemab in Early Symptomatic Alzheimer Disease: The TRAILBLAZER-ALZ 2 Randomized Clinical Trial.” JAMA 330 (6): 512–27.
-
Widera, Eric W., Sharon A. Brangman, and Nathaniel A. Chin. 2023. “Ushering in a New Era of Alzheimer Disease Therapy.” JAMA, July.